Во раните утрински часови на 29 декември, NEJM објави онлајн нова клиничка студија од фаза III за новиот кинески коронавирус VV116. Резултатите покажаа дека VV116 не е полош од Paxlovid (нематовир/ритонавир) во однос на времетраењето на клиничкото закрепнување и имал помалку несакани ефекти.
Извор на сликата: NEJM
Средно време на закрепнување 4 дена, стапка на несакани ефекти 67,4%
VV116 е орален нуклеозиден лек против нов коронавирус (SARS-CoV-2) развиен во соработка со Junsit и Wang Shan Wang Shui, и е RdRp инхибитор заедно со ремдесивир на Gilead, молнупиравир на Merck Sharp & Dohme и азелвудин на Real Biologics.
Во 2021 година, во Узбекистан беше завршено клиничко испитување од фаза II на VV116. Резултатите од студијата покажаа дека групата VV116 може подобро да ги подобри клиничките симптоми и значително да го намали ризикот од прогресија кон критична форма и смрт во споредба со контролната група. Врз основа на позитивните резултати од ова испитување, VV116 е одобрен во Узбекистан за третман на пациенти со умерена до тешка COVID-19 и стана првиот нов орален коронарен лек одобрен за пласман во странство во Кина [1].
Ова клиничко испитување од фаза III[2] (NCT05341609), предводено од проф. Жао Рен од болницата Шангај Руиџин, проф. Гаојуан од болницата Шангај Ренџи и академик Нинг Гуанг од болницата Шангај Руиџин, беше завршено за време на епидемијата предизвикана од варијантата Омикрон (B.1.1.529) од март до мај во Шангај, со цел да се процени ефикасноста и безбедноста на VV116 наспроти Paxlovid за рано лекување на пациенти со лесен до умерен COVID-19. Целта беше да се процени ефикасноста и безбедноста на VV116 наспроти Paxlovid за рано лекување на пациенти со лесен до умерен COVID-19.
Извор на слика: Референца 2
Мултицентрично, слепо, рандомизирано, контролирано испитување на 822 возрасни пациенти со Ковид-19 со висок ризик од прогресија и со благи до умерени симптоми беше спроведено помеѓу 4 април и 2 мај 2022 година за да се процени подобноста на учесниците од седум болници во Шангај, Кина. На крајот, 771 учесник примиле или VV116 (384, 600 mg на секои 12 часа на ден 1 и 300 mg на секои 12 часа на денови 2-5) или Paxovid (387, 300 mg ниматувир + 100 mg ритонавир на секои 12 часа во тек на 5 дена) како орален лек.
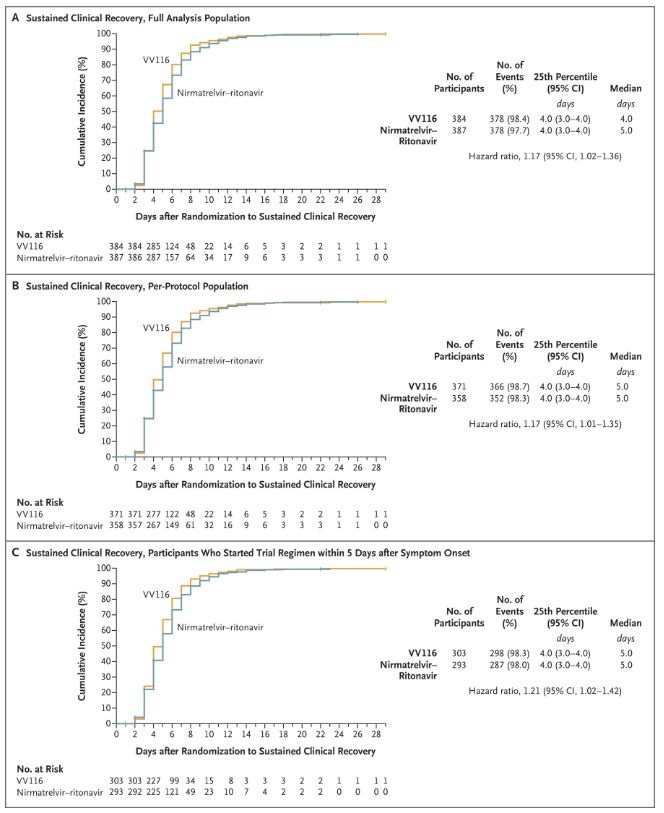
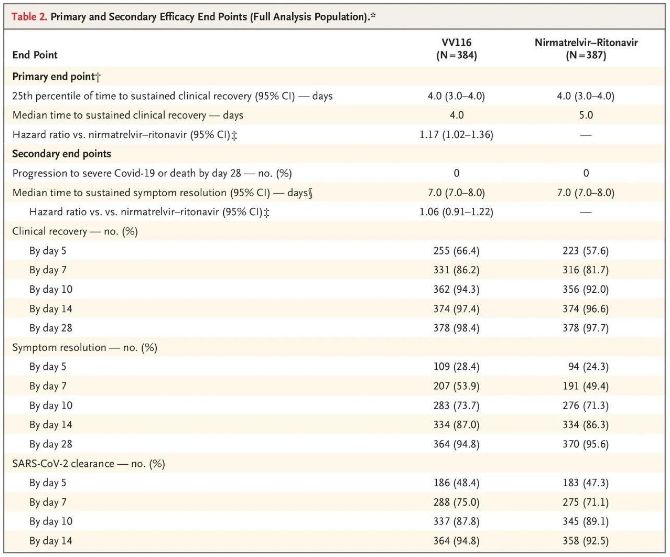
Резултатите од оваа клиничка студија покажаа дека раниот третман со VV116 за лесна до умерена COVID-19 ја исполни примарната крајна цел (време до одржливо клиничко закрепнување) предвидена со клиничкиот протокол: средното време до клиничко закрепнување беше 4 дена во групата VV116 и 5 дена во групата Paxlovid (сооднос на ризик, 1,17; 95% CI, 1,02 до 1,36; долна граница >0,8).
Одржување на времето на клиничко закрепнување
Примарни и секундарни крајни точки на ефикасност (сеопфатна анализа на популацијата)
Извор на слика: Референца 2
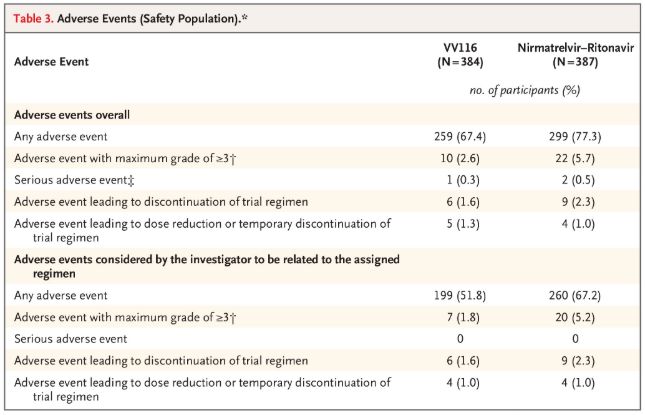
Во однос на безбедноста, учесниците кои примале VV116 пријавиле помалку несакани ефекти (67,4%) од оние кои примале Paxlovid (77,3%) при 28-дневниот период на следење, а инциденцата на несакани ефекти од степен 3/4 била помала за VV116 (2,6%) отколку за Paxlovid (5,7%).
Несакани настани (безбедни луѓе)
Извор на слика: Референца 2
Контроверзии и прашања
На 23 мај 2022 година, Juniper објави дека клиничката студија за регистрација во фаза III на VV116 наспроти PAXLOVID за рано лекување на благ до умерен COVID-19 (NCT05341609) ја исполни својата примарна крајна цел на студијата.
Извор на слика: Референца 1
Во време кога недостасуваа детали за испитувањето, контроверзноста околу студијата во фаза III беше двојна: прво, тоа беше еднослепа студија и, во отсуство на плацебо контрола, се стравуваше дека ќе биде тешко лекот да се процени целосно објективно; второ, имаше прашања во врска со клиничките крајни точки.
Клиничките критериуми за вклучување на смреката се (i) позитивни резултати за тестот за нова круна, (ii) еден или повеќе благи или умерени симптоми на COVID-19 и (iii) пациенти со висок ризик од тежок облик на COVID-19, вклучително и смрт. Сепак, единствената примарна клиничка крајна точка е „време до одржливо клиничко закрепнување“.
Непосредно пред објавувањето, на 14 мај, Џунипер ги ревидираше клиничките крајни точки со отстранување на една од примарните клинички крајни точки, „пропорција на конверзии во сериозна болест или смрт“ [3].
Извор на слика: Референца 1
Овие две главни спорни точки беа посебно разгледани и во објавената студија.
Поради ненадејната појава на Омикрон, производството на плацебо таблети за Паксловид не беше завршено пред почетокот на испитувањето и затоа истражувачите не беа во можност да го спроведат ова испитување користејќи двојно слеп, двојно проблив дизајн. Што се однесува до еднослепиот аспект на клиничкото испитување, Џунипер рече дека протоколот е спроведен по комуникација со регулаторните органи и дека еднослепиот дизајн значи дека ниту истражувачот (вклучувајќи го и евалуаторот на крајната точка на студијата) ниту спонзорот нема да ја знаат специфичната распределба на терапевтските лекови сè додека конечната база на податоци не биде заклучена на крајот од студијата.
До моментот на конечната анализа, ниту еден од учесниците во испитувањето не доживеал смрт или прогресија во тежок настан на Ковид-19, па затоа не можат да се извлечат заклучоци за ефикасноста на VV116 во спречувањето на прогресија во тежок или критичен Ковид-19 или смрт. Податоците покажаа дека проценетото средно време од рандомизација до одржлива регресија на целните симптоми поврзани со Ковид-19 било 7 дена (95% CI, 7 до 8) во обете групи (сооднос на опасност, 1,06; 95% CI, 0,91 до 1,22) [2]. Не е тешко да се објасни зошто примарната крајна точка „стапка на конверзија во тешка болест или смрт“, која првично беше поставена пред крајот на испитувањето, беше отстранета.
На 18 мај 2022 година, списанието Emerging Microbes & Infections ги објави резултатите од првото клиничко испитување на VV116 кај пациенти инфицирани со варијантата Омикрон [4], отворена, проспективна кохортна студија со 136 потврдени хоспитализирани пациенти.
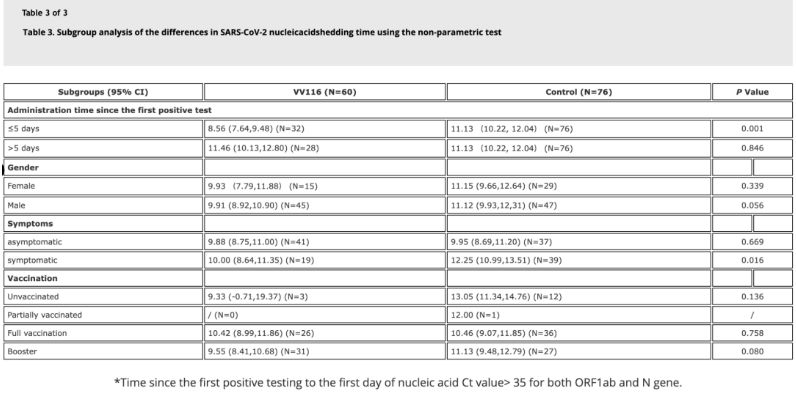
Податоците од студијата покажаа дека пациентите со инфекција со Омикрон кои користеле VV116 во рок од 5 дена од нивниот прв позитивен тест за нуклеинска киселина имале време до регресија на нуклеинската киселина од 8,56 дена, помалку од 11,13 дена во контролната група. Администрацијата на VV116 кај симптоматски пациенти во временската рамка на оваа студија (2-10 дена од првиот позитивен тест за нуклеинска киселина) го намалила времето до регресија на нуклеинската киселина кај сите пациенти. Во однос на безбедноста на лекот, не се забележани сериозни несакани ефекти во групата за третман со VV116.
Извор на слика: Референца 4
Во тек се три клинички испитувања на VV116, од кои две се студии од фаза III за благ до умерен COVID-19 (NCT05242042, NCT05582629). Другото испитување за умерен до тежок COVID-19 е меѓународна мултицентрична, рандомизирана, двојно слепа клиничка студија од фаза III (NCT05279235) за да се процени ефикасноста и безбедноста на VV116 во споредба со стандардниот третман. Според соопштението од Juniper, првиот пациент бил запишан и примен во март 2022 година.
Извор на слика: clinicaltrials.gov
Референци:
[1] Junshi Biotech: Соопштение за главната крајна точка на регистрираната клиничка студија од фаза III на VV116 наспроти PAXLOVID за ран третман на лесен до умерен COVID-19
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Енси Ма, Џингвен, Џунгвен, Аи, Јиномингинги Ксу, Хао Јин, Жирен Фу, Хао Ксинг, Ли Ли, Лијинг Сон, Хеју Хуанг, Куанбао Џанг, Линлин Ксу, Јантинг Џин, Руи Чен, Гуоју Лв, Жијун Жу, Венхонг Џанг, Женгксин Ванг. (2022) Профил на инфекции со Омикрон и статус на вакцинација кај 1881 приматели на трансплантација на црн дроб: мултицентрична ретроспективна група. Нови микроби и инфекции 11:1, страници 2636-2644.
Време на објавување: 06.01.2023
 中文网站
中文网站